Vous souhaitez accéder au marché en Europe et/ou à l’international, vous recherchez un mandataire ou une PCVRR, vous souhaitez accéder au remboursement de vos produits sur le marché français ? CEISO vous accompagne.
Vous êtes fabricant hors Union Européenne et vous envisagez de commercialiser vos dispositifs médicaux sur le marché européen ?
La réglementation vous impose de faire appel aux services d’un mandataire.
Nous sommes à votre disposition en tant que mandataire enregistré sur la base EUDAMED sous le N° FR-AR000000342.
Vous êtes implanté sur le territoire européen et vous envisagez d’y commercialiser vos dispositifs ?
Vous devez vous conformer aux exigences de la réglementation européenne relative aux dispositifs médicaux (2017/745 et 2017/746).

Afin que votre dispositif soit conforme aux exigences de sécurité et de performances fixées par la réglementation européenne
Vous êtes mandataire ou une TPE soumis à la règlementation européenne sur les Dispositifs Médicaux ?
Vous êtes dans l’obligation d’avoir une personne chargée de veiller au respect de cette réglementation (PCVRR)
Cette fonction peut être externalisée.
Nous mettons à votre disposition les ressources compétentes nécessaires.
Un mandataire est « toute personne physique ou morale établie dans l’Union ayant reçu et accepté un mandat écrit d’un fabricant, situé hors de l’Union, pour agir pour le compte du fabricant aux fins de l’accomplissement de tâches déterminées liées aux obligations incombant à ce dernier en vertu du présent règlement ».
Cette représentation obligatoire permet aux autorités d’être en mesure de contacter une personne responsable, domiciliée sur le territoire européen, désignée pour agir au nom et pour le compte d’un fabricant situé hors Europe, notamment en cas d’urgence.

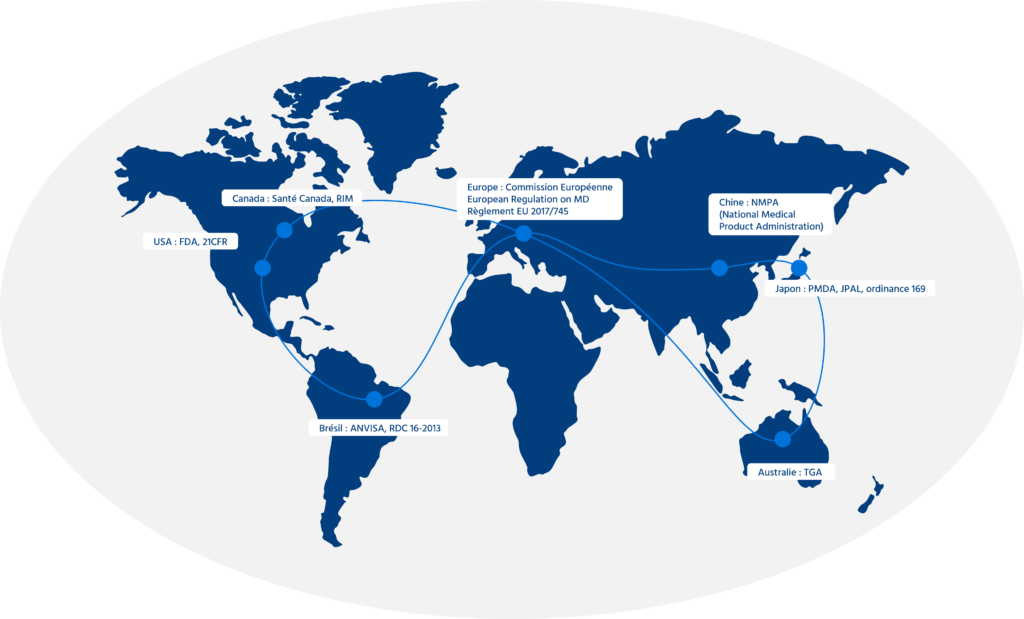
Vous souhaitez commercialiser vos dispositifs médicaux en Chine ou sur le marché Nord Américain ?
Nous vous accompagnons dans vos démarches :
Nous contacter
CEISO vous accompagne dans la constitution du dossier de demande de remboursement de vos produits et prestations.
Toute demande d’inscription de votre dispositif médical sur les listes des produits et prestations remboursables (LPPR) doit être soumise à la Commission Nationale d’Evaluation des Dispositifs Médicaux et des Technologies de Santé (CNEDiMTS) selon l’article L.165-1 du code de la sécurité sociale.
CEISO vous accompagne dans la constitution de votre dossier de demande de remboursement.
Votre problématique concerne l’accès au marché ? Nous vous invitons à préciser votre besoin via le formulaire de contact. Nous reviendrons vers vous dans les plus brefs délais.
Découvrez CEISO Academy, notre service d’e-learning clé en main sur le règlement européen relatif aux Dispositifs Médicaux EU 2017/745 (MDR)