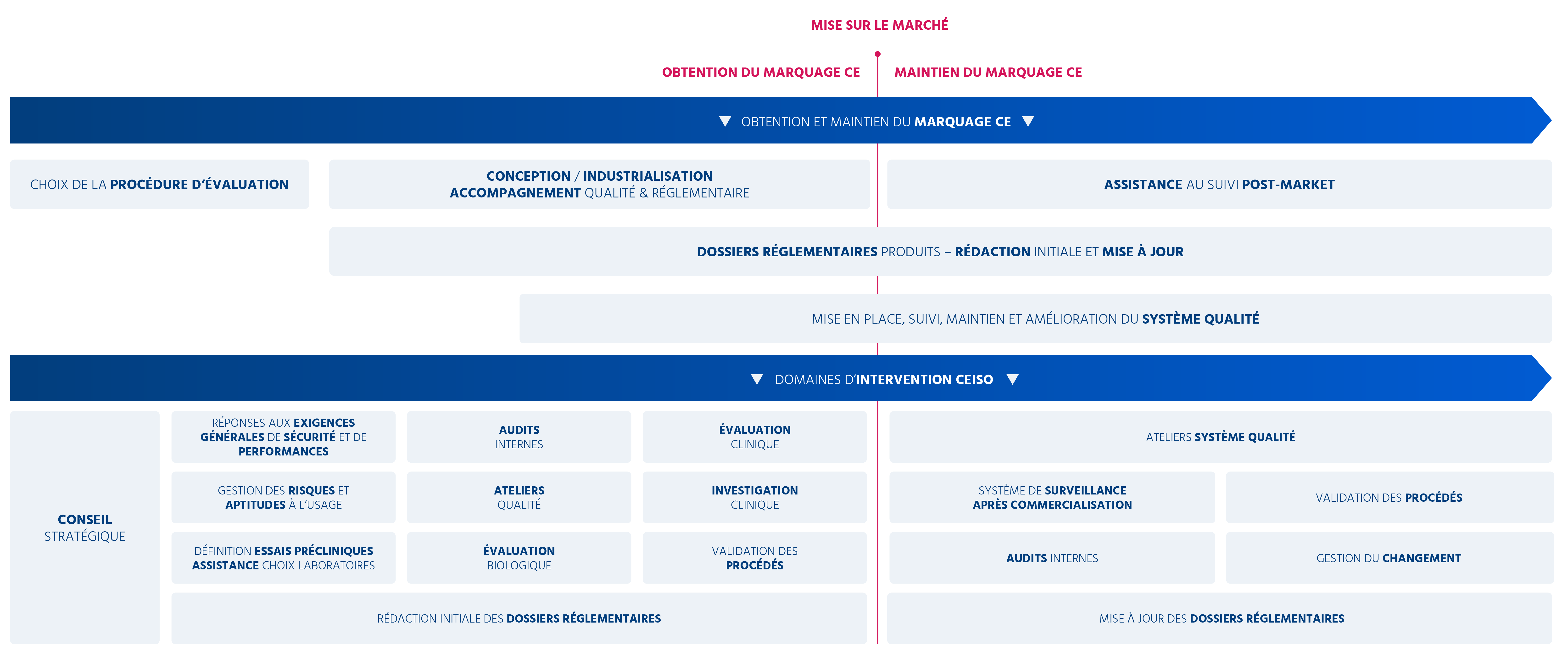
Depuis la phase de conseil stratégique jusqu’à l’assistance au suivi post-commercialisation, notre équipe travaille à vos côtés pour vous permettre d’accéder aux marchés en toute quiétude.
Vous avez une problématique ponctuelle, des questions notamment sur la stratégie réglementaire impactant le développement de votre entreprise, de vos produits.
Vous êtes une start-up et souhaitez accéder à différents marchés.
Nous mettons notre expérience à votre disposition pour du conseil ponctuel sur l’application des réglementations.
Vous devez mettre en place un Système de Management par la Qualité, le faire évoluer en fonction des contraintes réglementaires et de vos objectifs ?
Nous vous accompagnons dans toutes les étapes de votre démarche.
Nos prestations incluent également la réalisation d’audits internes et sous-traitants tout comme la préparation aux audits de certification ou inspection par les autorités compétentes.
Nos accompagnements s’adaptent à vos besoins.
Pour la mise en place d’un Système Qualité conforme aux référentiels qualité des métiers du secteur biomédical (ISO 13485, 21 CFR 820, BPL, BPF, etc.).
Pour le maintien, l’évolution et la maîtrise de votre Système Qualité en l’adaptant à votre stratégie et aux évolutions normatives et réglementaires.
Pour la simplification et l’optimisation de votre Système Qualité afin de gagner en agilité, en adaptabilité et donc, en efficacité.
Vous envisagez de commercialiser un dispositif ? Vous avez l’obligation de constituer des dossiers techniques conformes aux exigences des réglementations applicables ?
Suivant le profil risque du produit, son examen par des instances réglementaires peut être requis.
Ces dossiers doivent être présentés de manière claire, organisée et non ambiguë, sous une forme facilement consultable, et comprenant tous les éléments requis par les réglementations.
Vous souhaitez évaluer le fonctionnement et l’efficacité de votre système qualité en toute objectivité ? Vous manquez de ressource pour réaliser un audit interne ? Pour réaliser vos audits, CEISO met à votre disposition son équipe d’auditeurs.
Au-delà des constats d’audit, nous vous proposons, tout au long du process, des pistes d’amélioration sur les points audités.
Dans le cadre de vos obligations de surveillance de votre Système Qualité (SMQ).
Dans un objectif de préparation à vos audits de certification ou à vos inspections par des autorités de santé.
Audits préparés en amont avec vous, afin de vous assurer du respect des obligations contractuelles de vos prestataires.
Dans le cadre de la résolution de problèmes opérationnels, de la validation de vos procédés, de la reprise d’entreprise, de la sélection de fournisseurs/sous-traitants.
Prestation d’assistance lors d’audits de certification, d’inspections sur site ou de convocations par les autorités de santé.
Vous souhaitez mettre un dispositif sur le marché européen ? Vous devez vous conformer à la réglementation applicable.
Notre équipe pluridisciplinaire est à vos côtés pour répondre à l’ensemble de vos obligations.
Nous vous accompagnons pour démontrer la sécurité et la performance du dispositif notamment au travers de :
La veille réglementaire et normative est une exigence. Elle permet l’anticipation des réglementations et des textes normatifs susceptibles d’avoir une influence sur vos produits, vos activités ou sur votre stratégie d’entreprise.
Devant les fréquents changements réglementaires et la complexification des textes, bénéficiez d’une veille réglementaire et normative efficace en mobilisant un minimum de ressources internes.
Votre dispositif est au contact direct ou indirect avec le corps ? Vous devez alors maîtriser les risques toxicologiques et biologiques.
Nos prestations sont réalisées avec l’expertise de toxicologues dont les compétences sont reconnues au niveau européen.
Sur demande, nous vous accompagnons dans la préparation éventuelle du protocole des tests et la recherche des laboratoires.
Pour chaque dispositif médical commercialisé, le fabricant doit concevoir, établir, documenter, appliquer, maintenir et mettre à jour un système de surveillance après commercialisation et surveillance clinique après commercialisation.
Vous avez des difficultés à mettre en œuvre ces exigences : nous vous formons et vous accompagnons dans l’élaboration et l’application de cette surveillance.
Votre problématique concerne la Qualité et/ou la Réglementation ? Nous vous invitons à préciser votre besoin via le formulaire de contact.
Nous reviendrons vers vous dans les plus brefs délais.
Découvrez CEISO Academy, notre service d’e-learning clé en main sur le règlement européen relatif aux Dispositifs Médicaux EU 2017/745 (MDR)